-
海洋生物毒素是一类由海洋生物产生的天然活性物质,具有化学结构新颖,生物活性高,作用于钠、钾、钙等离子通道等特点,有望开发为先导化合物,为新型海洋药物的研发提供新策略,但其强烈毒性和高致死率也对人类健康产生巨大威胁[1]。目前,药物毒性评价多采用细胞模型和动物模型,由于细胞模型不能重现体内真实环境,动物模型存在伦理和物种差异等问题,近年来,在微流控技术基础上发展起来的器官芯片模型,可以模拟体内组织器官的结构和功能,再现体内微环境,在药物毒性评价与检测领域展现出极大潜力。本文构建了一种可模拟心血管结构与功能的心血管芯片模型,用于四种典型的深海毒素,即大田软海绵酸(OA)、芋螺毒素(CTX)、河豚毒素(TTX)和环亚胺毒素(GYM)的致伤评价,并初步探索了雷公藤甲素对毒素致伤的保护作用,旨在为深海毒素的防护提供参考。
-
SC-1B匀胶机、BP-2B型烘胶台(北京创世威纳科技有限公司);JKG-2A光刻机(上海学泽光学机械有限公司);PDC-32G-2型等离子清洗机(美国Harrick公司);CKX41型高倍显微镜(日本OLYMPUS公司);Harris Uni-Corel 15072型打孔器(美国Harris公司);超净工作台、CO2细胞培养箱、离心机、超低温冰箱(美国Thermo Fisher公司);Synergy 4多功能酶标仪(美国Bio-TEK公司);Harvard蠕动泵p-70(美国Harvard仪器公司);十万分之一电子分析天平(日本A&D公司)。
聚二甲基硅氧烷(PDMS)预聚剂和固化剂(美国Dow Corning公司);硅单面抛光片、显影液(苏州汶颢芯片科技有限公司);SU-82 075光刻胶(美国Microchem公司)、磷酸盐缓冲盐(PBS)、96培养孔板(美国Corning公司);无菌注射器(江苏恒康公司);PE/20软管(美国Scientific Commodities公司);多聚赖氨酸溶液(北京索莱宝科技有限公司);DMEM/F-12培养基(美国Hyclone公司);胎牛血清(加拿大MULTICELL公司);青霉素-链霉素溶液、胰蛋白酶(美国Gibco公司);CCK-8检测试剂盒(大连美仑生物有限公司);山羊血清、Tween-20溶液(碧云天生物科技公司);荧光素异硫氰酸酯标记的小麦胚芽凝集素(WGA-FITC)、二甲基亚砜(DMSO)、大田软海绵酸、河豚毒素、环亚胺毒素(北京普华仕科技发展有限公司);芋螺毒素(上海楚肽生物科技有限公司);雷公藤甲素(上海陶素生物科技有限公司)。所有化学试剂除特殊说明外均为分析纯。
-
精密称取OA溶解于DMSO,配置浓度为31 μmol/L的储备液;CTX溶解于超纯水中,配置浓度为200 μmol/L的储备液;TTX溶解于0.1%甲酸溶液,配置浓度为313 μmol/L的储备液;5 μmol/L的GYM标准溶液,氮气吹干后培养基复溶,于−20 ℃保存。用培养基稀释至低、中、高三个浓度的溶液:OA(10、50、100 nmol/L)、CTX(0.5、5、20 μmol/L)、TTX(0.04、0.4、4 μmol/L)、GYM(4、10、40 μmol/L)。雷公藤甲素溶解于DMSO,配置浓度为10 mmol/L的储备液,培养基稀释至实验浓度0.5、1、3、10、20、50 μmol/L。
-
人脐静脉内皮细胞(HUVEC)购买自美国ATCC细胞库,培养于含10%胎牛血清和1%青霉素-链霉素的DMEM/F-12培养基中,置于37 ℃、5% CO2培养箱中培养,取对数生长期细胞用于后续实验。
-
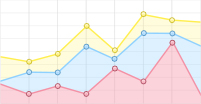
使用AutoCAD软件设计、软光刻技术制备三通道并列的微流控芯片,如图1所示。将凝血酶(4 U/ml)、PBS和纤维蛋白原(100 mg/ml)按25∶22∶3比例混匀加入芯片胶原通道;血管通道加入PBS稀释的基质胶(1∶50,V/V)后加入对数生长期的HUVEC细胞(3×106 cells/ml);在外部设备上,使用蠕动泵灌注培养基,人体血流剪切应力为5~20 dyn/cm2,参照剪切应力公式τ=6 μQ/h2w计算流体流速(其中τ为流体剪切应力,μ为流体粘滞度,Q为流体流速,h和w分别为芯片内细胞培养腔的高度和宽度),模拟细胞在体内所受的血流剪切应力,于体外重构心血管微环境[2]。
-
取对数生长期的HUVEC细胞,按5 000 cells/孔的细胞密度接种于96孔板,空白组不加细胞。24 h后吸除原培养基,空白组与正常对照组各孔中只加入细胞培养液,实验组中加入含有不同浓度的毒素试液,每孔100 μl,每组6个平行。24 h后观察细胞形态,向各组每孔中加入10%的CCK-8溶液,避光孵育1 h。酶标仪检测450 nm处各样品的吸光度值(OD)计算相对细胞活力。
相对细胞活力(%)=[(OD药物−OD空白)/(OD对照−OD空白)]×100
-
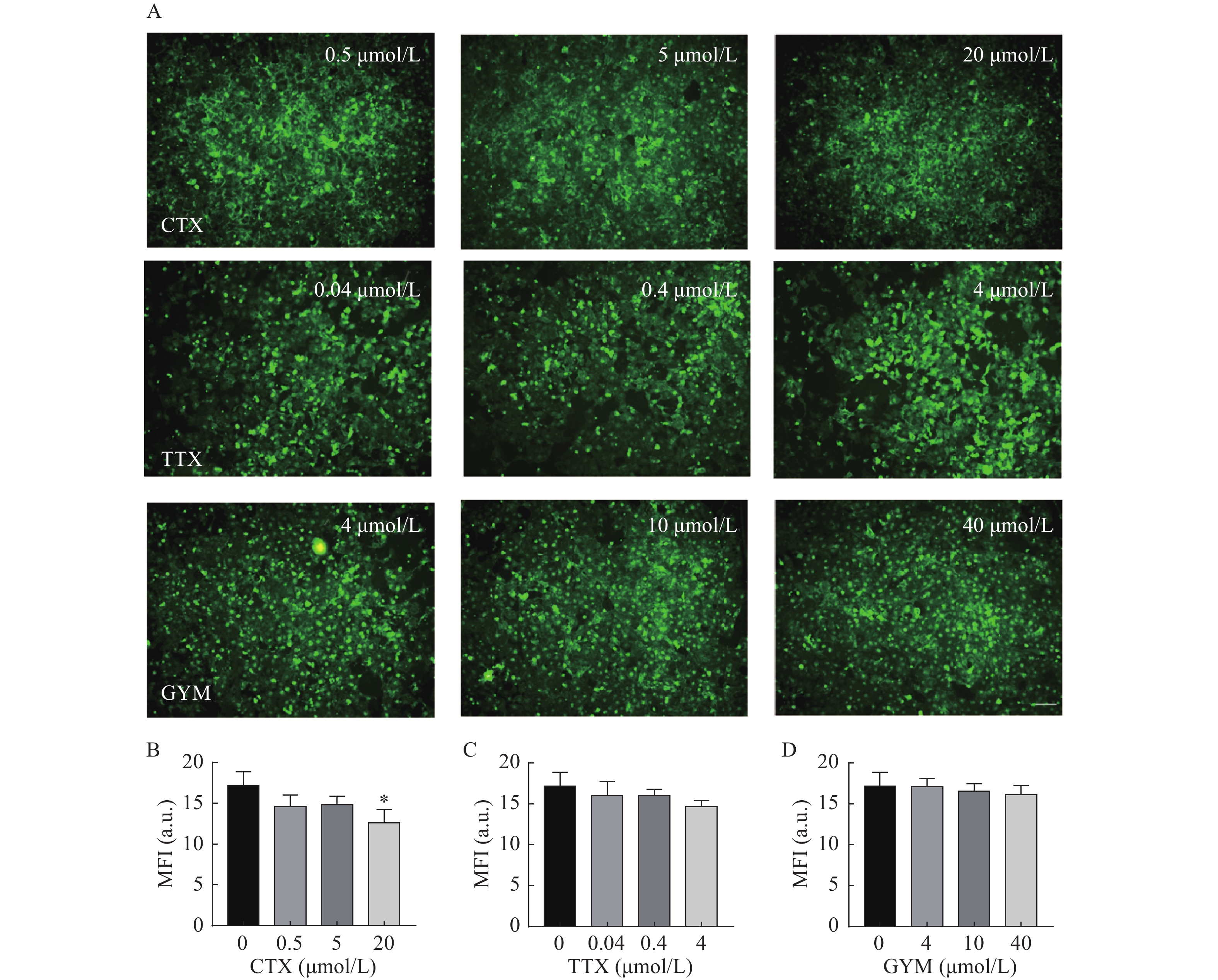
于心血管芯片模型血管通道加入20 μl不同浓度的毒素,24 h后用PBS缓慢润洗通道内细胞。将4%多聚甲醛缓慢注入到芯片微通道内,固定20 min,PBS润洗去除通道内残留的多聚甲醛。加入10%山羊血清的PBST(PBS+0.1% Tween-20),封闭30 min。在通道内加入适量的WGA-FITC(WGA-FITC∶PBS=1∶200,V/V
),避光孵育1 h。芯片通道PBS润洗3次,每次5 min,荧光倒置显微镜下观察并采集数据。根据毒素损伤前后WGA-FITC染色荧光强度(MFI)变化情况计算糖萼损伤率。 糖萼损伤率(%)=[1−(MFI损伤/MFI正常)]×l00
-
考察不同浓度的雷公藤甲素对HUVEC细胞活性的影响,筛选出雷公藤甲素的最佳预保护浓度用于后续实验。取对数生长期的HUVEC细胞接种于96孔板,向实验组、对照组各孔中分别加入雷公藤甲素预保护1 h。实验组加入不同浓度的毒素溶液,CCK-8法评价雷公藤甲素对毒素损伤后HUVEC细胞的保护作用,实验步骤详见“1.5”项。
采用上述构建的心血管芯片模型,于血管通道内加入雷公藤甲素预保护1 h后,实验组加入不同浓度的毒素,考察雷公藤甲素对毒素损伤血管糖萼组织保护作用,实验步骤详见“1.6”项。
-
采用Image J软件计算免疫荧光强度表达,GraphPad Prism 7统计学软件进行数据分析,组间比较采用单因素方差分析,*P<0.05,**P<0.01表示差异有统计学意义。
-
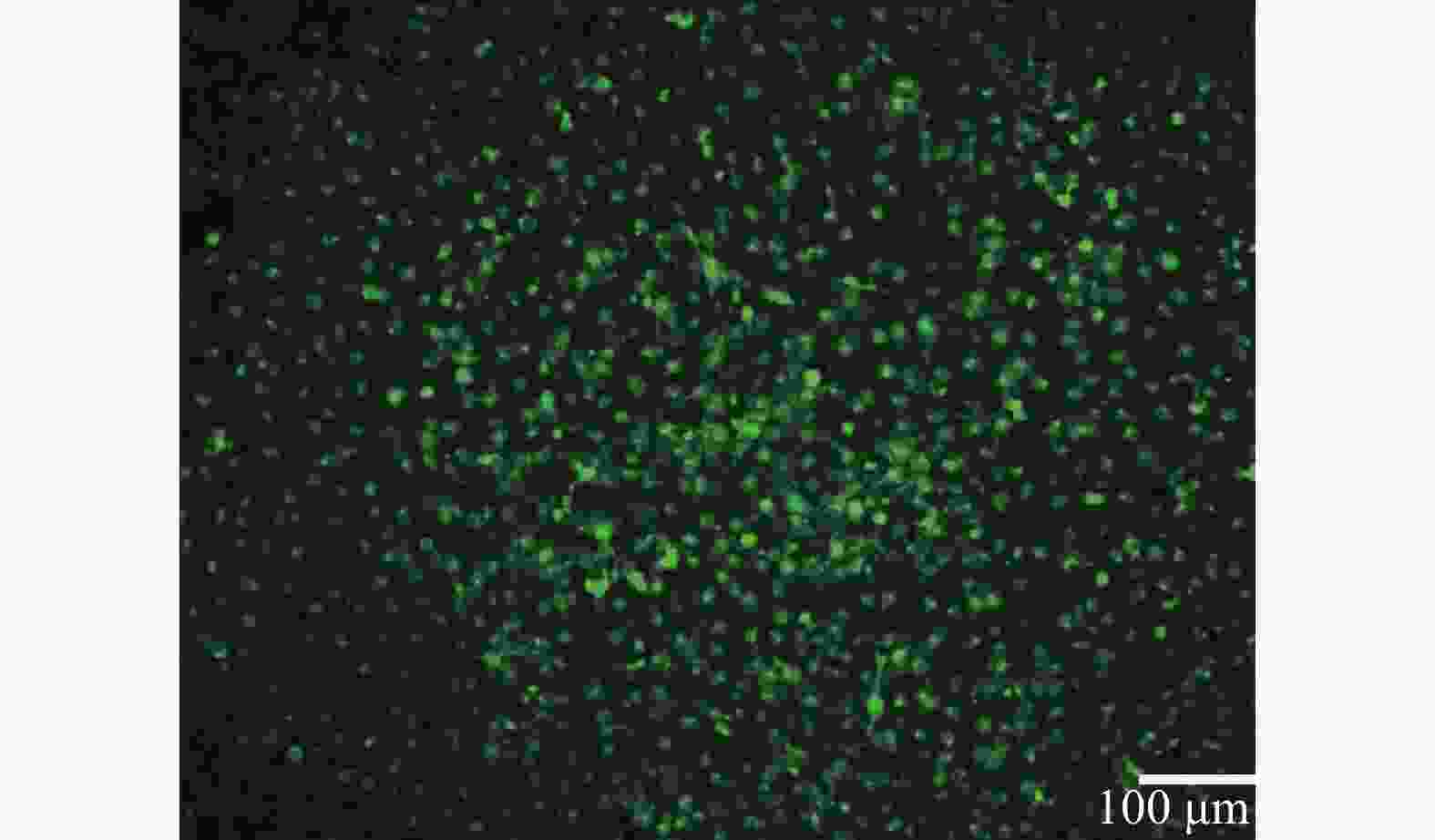
以1 μl/min的流速动态培养细胞,HUVEC细胞在所构建的心血管器官芯片模型中生长状态良好,存活率高。经WGA-FITC免疫荧光染色,可清楚观察到结构完整的血管内皮糖萼,符合体外心血管模型的要求,如图2所示。
-
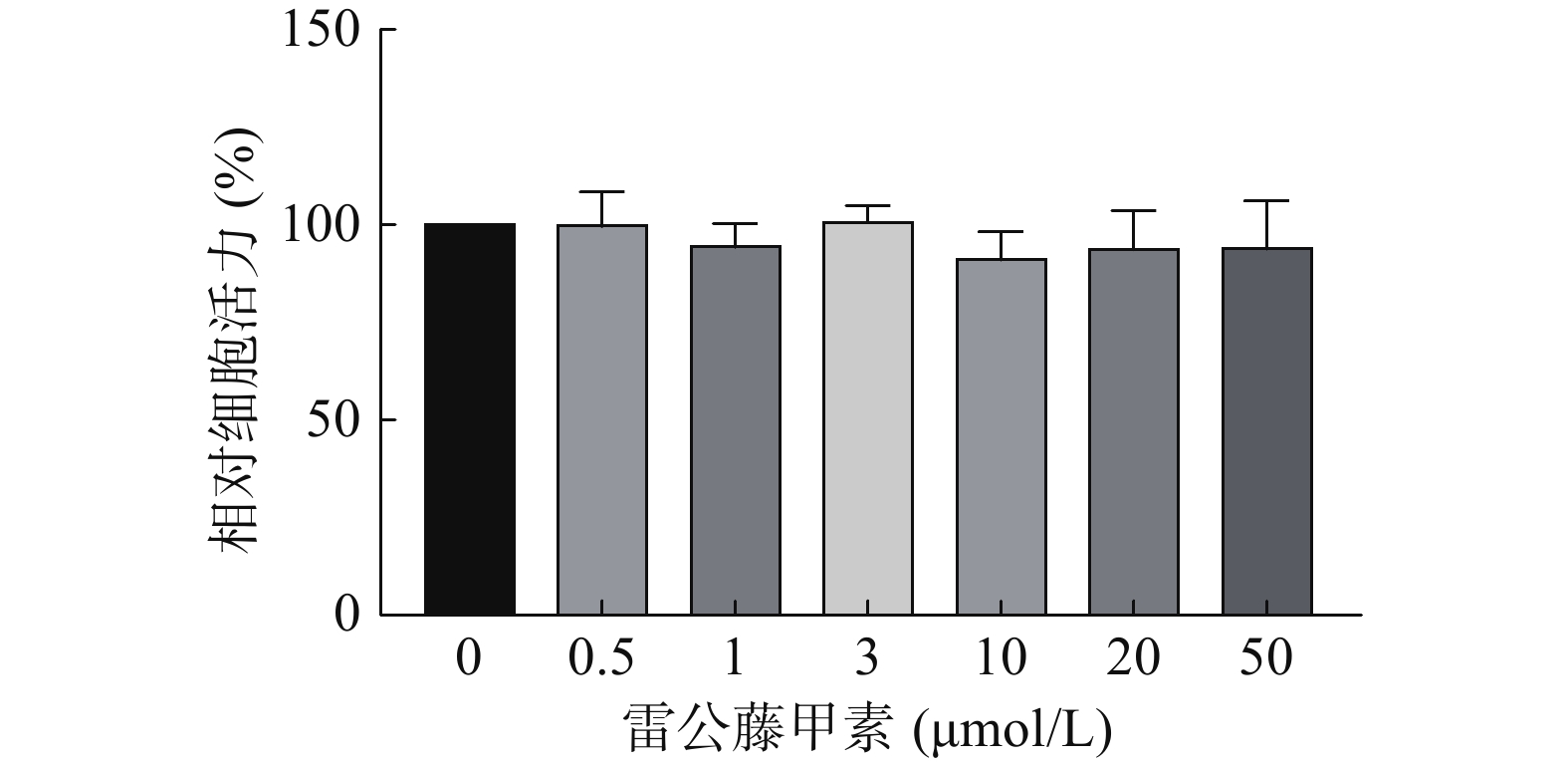
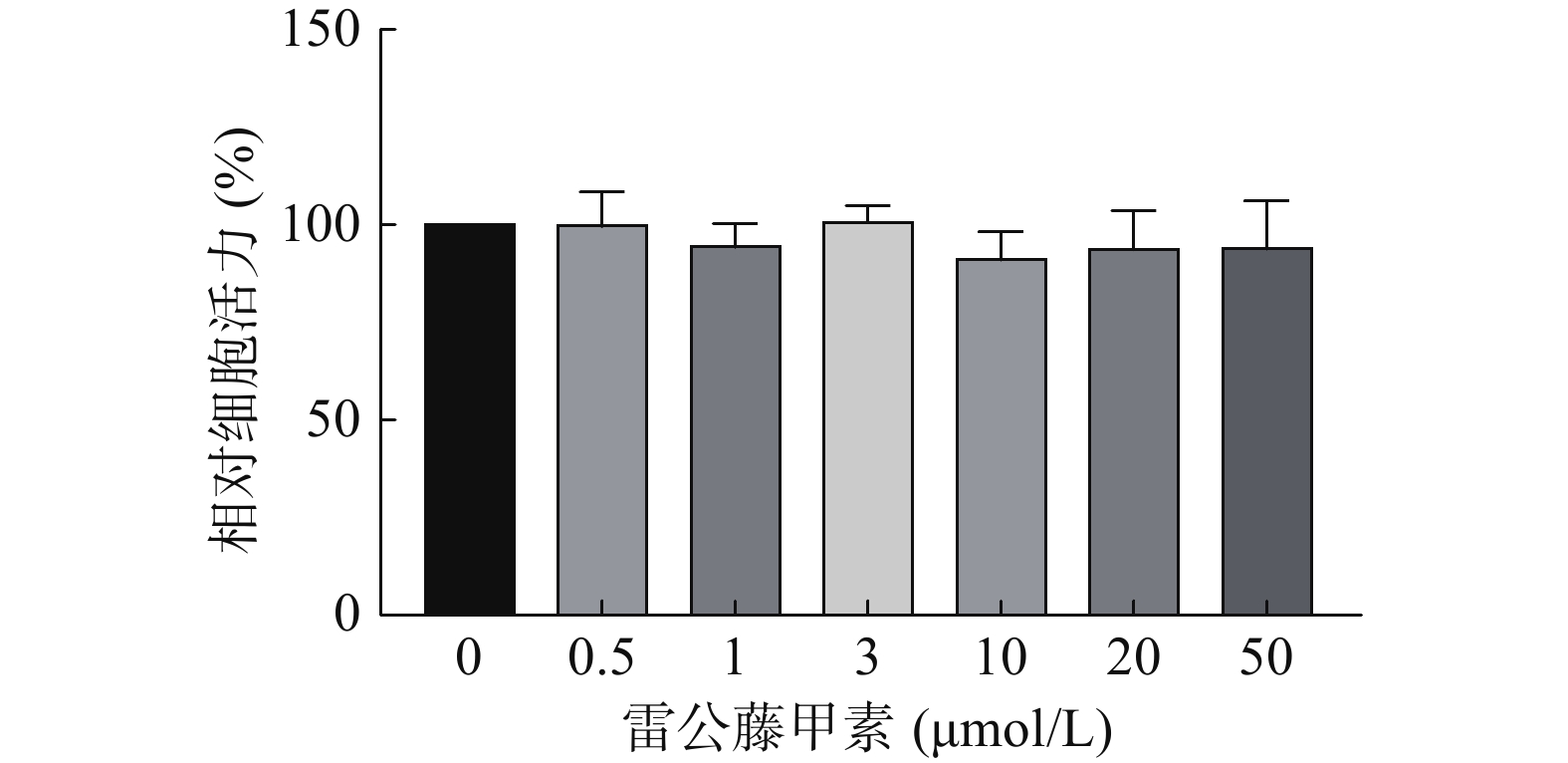
采用CCK-8法考察不同浓度的雷公藤甲素对HUVEC细胞活力的影响,结果如图3所示,在测试浓度范围内,雷公藤甲素对HUVEC细胞不存在明显的活力抑制,选择浓度为1 μmol/L的雷公藤甲素进行后续实验。
-
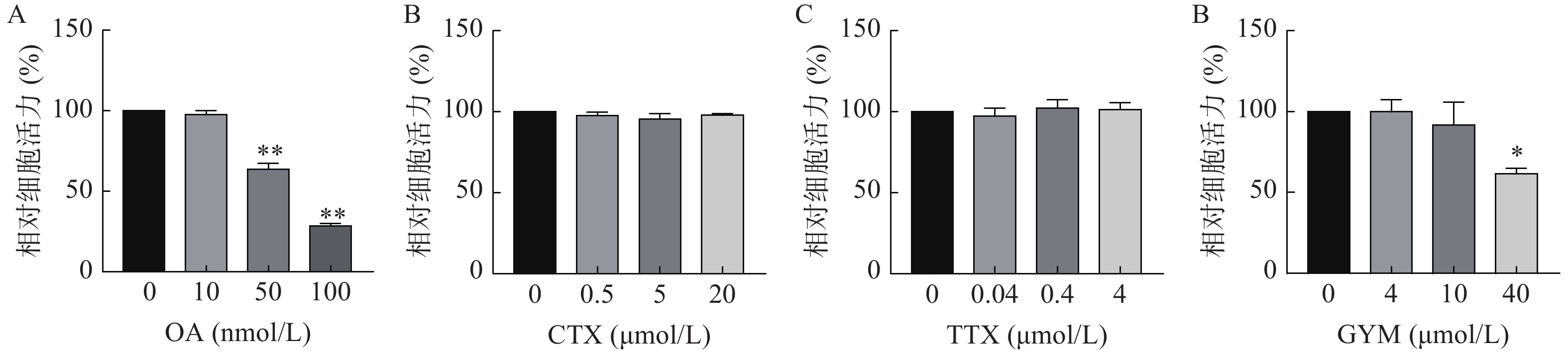
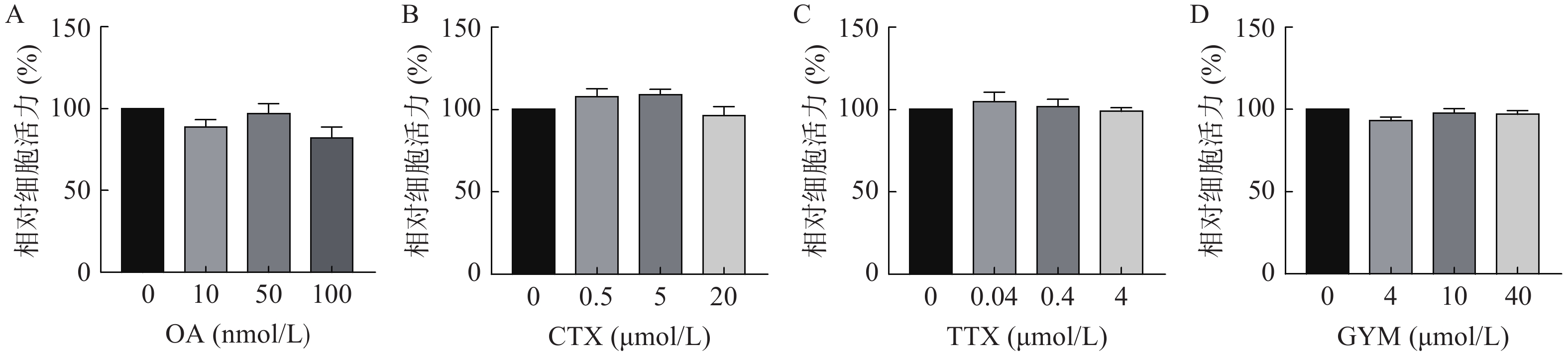
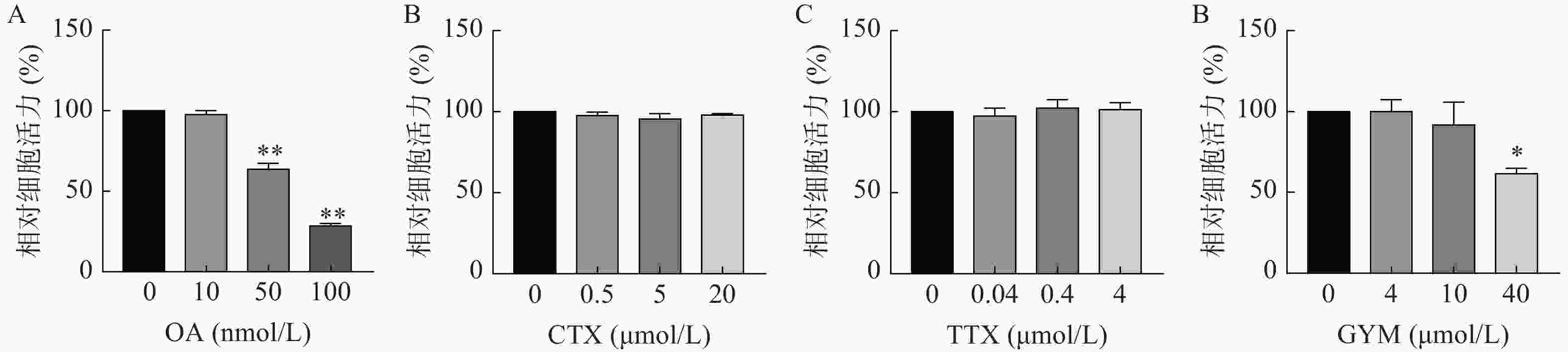
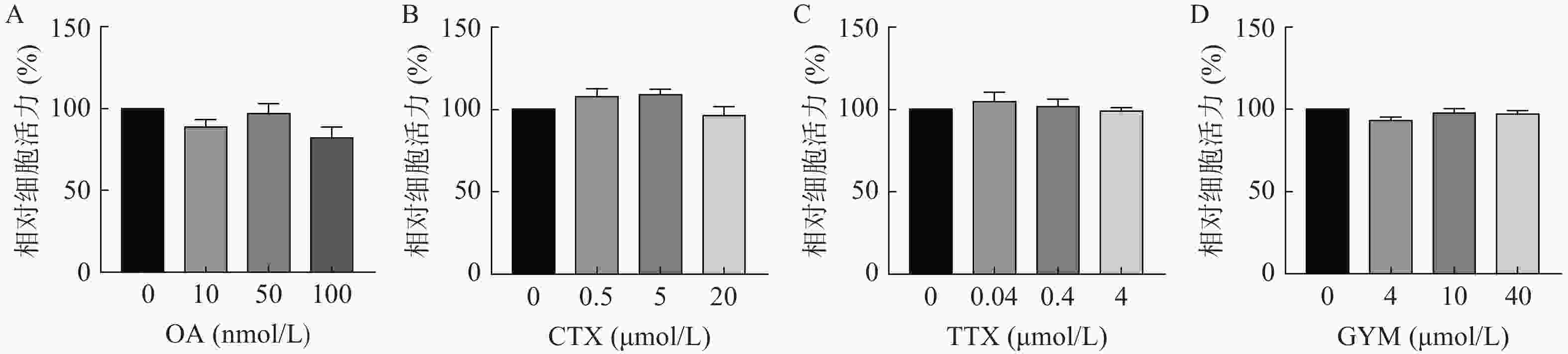
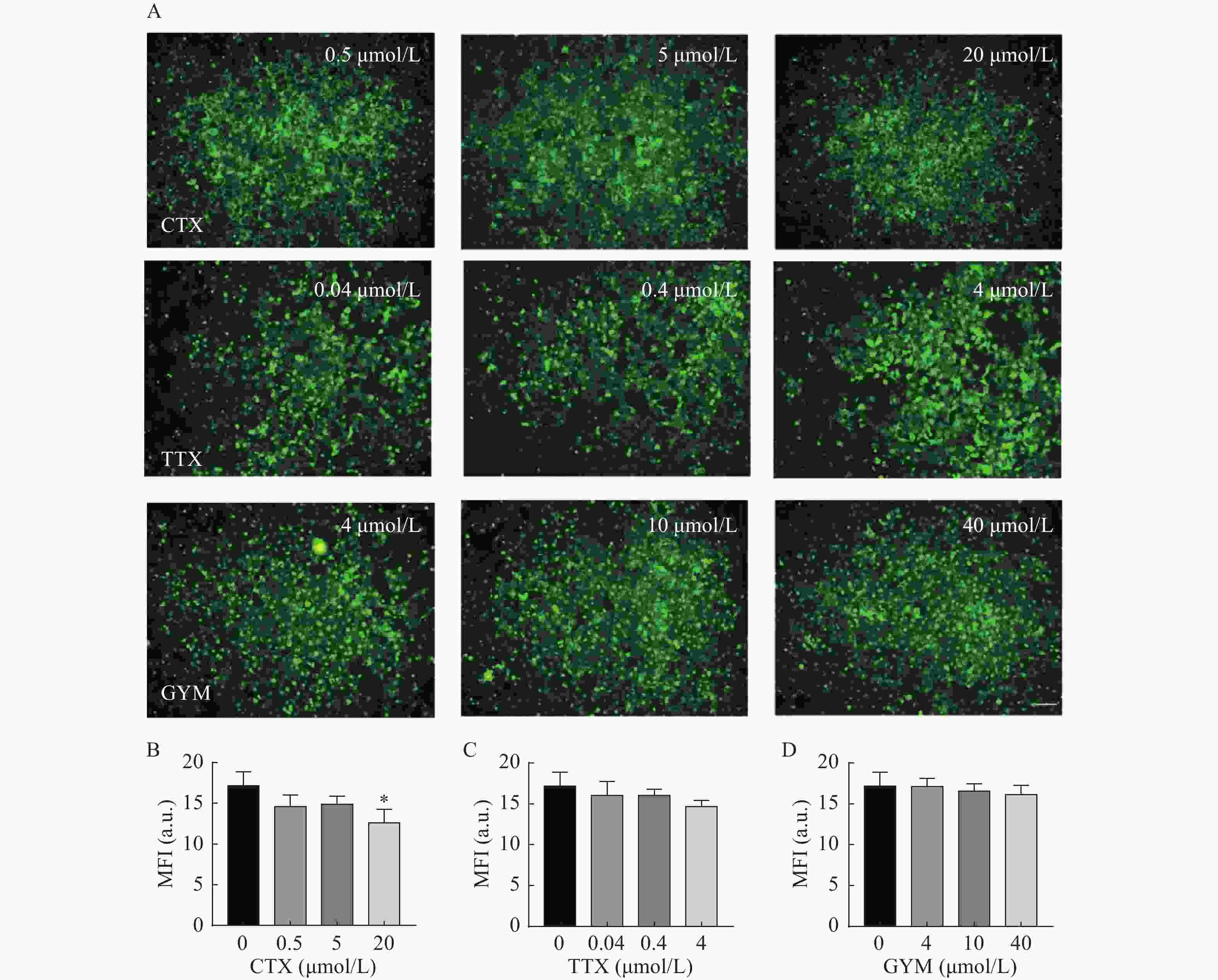
采用CCK-8法测定雷公藤甲素预保护前后,低、中、高三个浓度的毒素对HUVEC细胞活力的影响。与对照组相比,OA在中、高浓度下对细胞活力具有较强的抑制作用(P<0.01),其IC50为54.12 nmol/L。GYM在高浓度对细胞活力有较大影响(P<0.05),但是在加入1 μmol/L雷公藤甲素预保护后,OA与GYM对细胞的毒性显著降低,细胞活力与对照组相比无显著性差异,说明雷公藤甲素对OA和GYM损伤HUVEC细胞具有一定的保护作用。而CTX、TTX在雷公藤甲素预保护前后,对HUVEC细胞活力均无显著抑制作用,结果如图4、5所示。
-
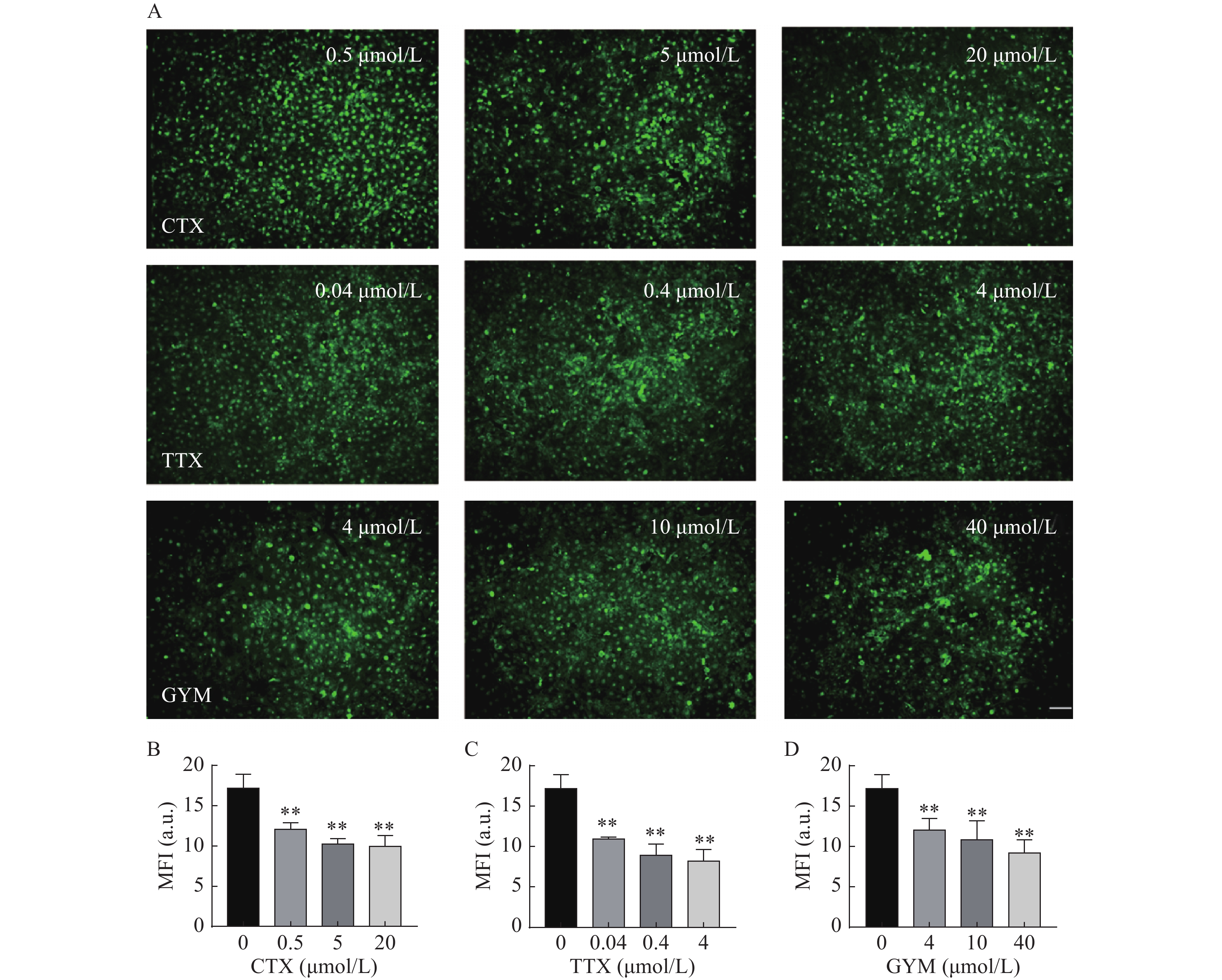
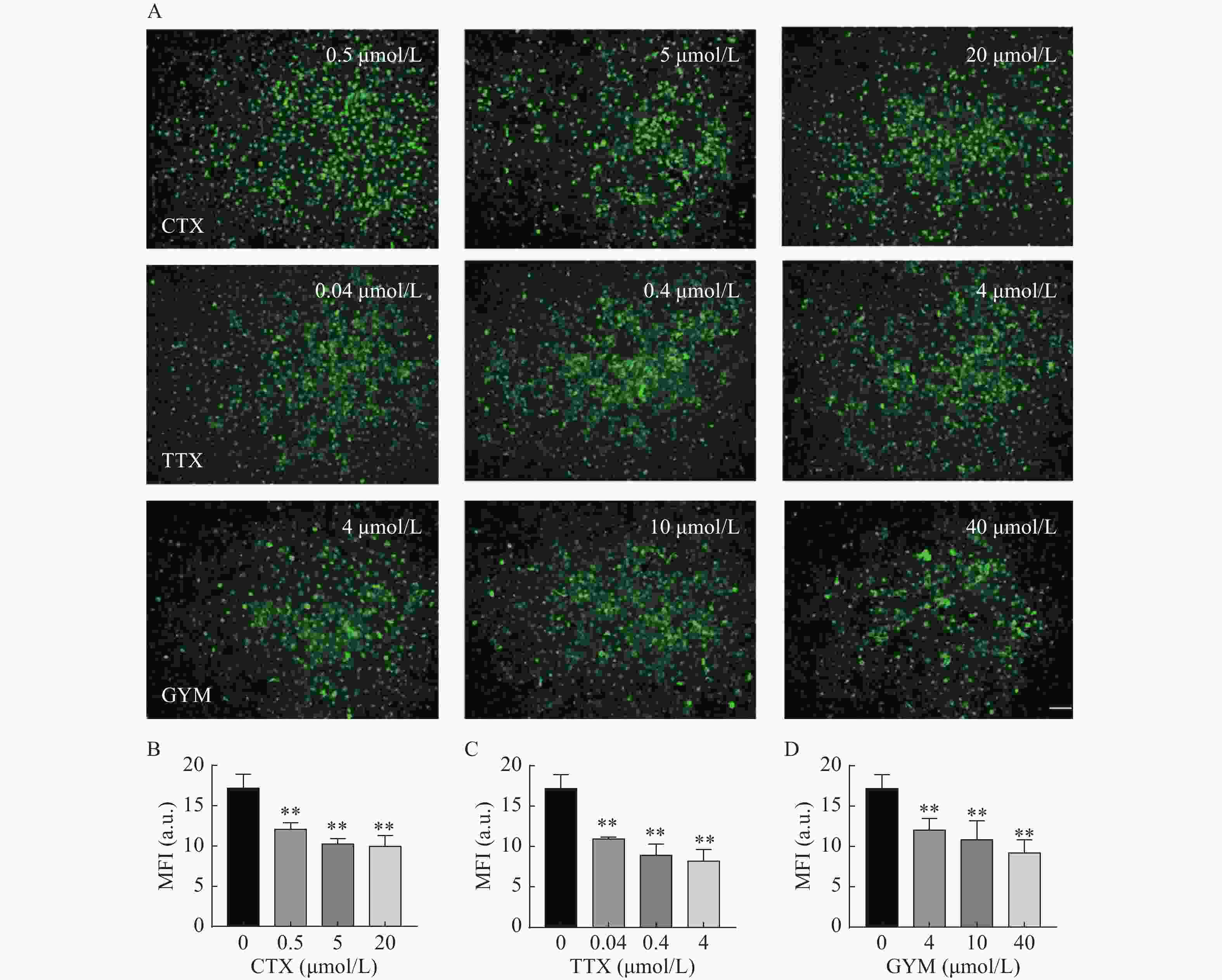
在所建立的心血管芯片平台上研究雷公藤甲素对四种毒素产生细胞内皮糖萼损伤的保护作用,免疫荧光染色结果如图6和图7所示。OA作用后,HUVEC细胞出现皱缩、变圆、体积变小等形态变化,且随着实验浓度的增大,所呈现的上述细胞形态变化加剧,培养液中可见大量细胞碎片和悬浮的死细胞,说明OA对HUVEC细胞毒性较强,不仅对细胞糖萼有较严重的损伤,还影响了细胞与芯片PDMS基底的贴附水平,心血管芯片结构和功能受损。CTX、TTX和GYM作用后,HUVEC细胞受到不同程度的损伤,内皮细胞糖萼的WGA-FITC染色荧光强度信号与对照组相比均明显降低,具有统计学意义(P<0.01)。经雷公藤甲素预保护后,低浓度OA所产生的细胞损伤得以减轻,糖萼损伤率为28.20%,但是中浓度和高浓度作用下的细胞依旧损伤严重。除OA外,其余三种毒素作用后的糖萼WGA-FITC染色荧光强度均有明显升高,糖萼损伤率见表1。
毒素 给药浓度(μmol/L) 糖萼损伤率(%) 预保护前 预保护后 CTX 0.5 36.30 14.90 5 48.04 13.47 20 52.28 26.52 TTX 0.04 29.55 6.52 0.4 40.30 6.69 4 41.97 14.60 GYM 4 23.53 0.22 10 25.89 3.65 40 40.41 6.01 -
海洋生物中的活性物质有很多,对海洋生物毒素研究却是冰山一角。海洋生物毒素根据化学结构的不同常分为三类:聚醚类、多肽类和生物碱类毒素[3]。OA是一种聚醚类化合物,是近年来研究最突出的一种海洋生物毒素,研究发现暴露于OA会导致细胞凋亡以及促进肿瘤和癌症的发生,对人体造成很大危害[4]。多肽类毒素以CTX最具代表性,CTX能特异性地作用于神经递质受体以及多种离子通道,不仅可直接作为药物,还可作为分子工具发展新药先导化合物,对神经生物学的研究具有重要意义[5]。TTX是一种生物碱类毒素,可选择性地与钠离子通道受体结合,研究发现,TTX的麻醉效果强,持续时间长,在镇痛、镇静方面应用前景广泛[6]。随着对海洋生物研究的深入,一些新的毒素也陆续被发现。GYM是一种具有环亚胺结构的毒素,相对于其他三种毒素发现较晚、毒性较弱,但其降解速度缓慢,存在长期毒性效应,在生态系统中的潜在风险不容忽视[7]。尽管海洋生物毒素的研究越来越受到人们的重视,但是现有的评价模型限制了毒素研究工作的进一步开展。
微流控器官芯片模型利用微流控技术对流体进行精确调控,模拟生物体内环境,在体外进行器官生理及病理状态的复制,到目前为止,已经实现肝、肾、肠道等多种器官芯片的构建,在药物筛选、药效和毒性评价方面显示出良好的应用前景[8]。大量研究表明,血液循环流动产生的剪切应力对内皮细胞分化、生长状态和功能表达有着重要作用[9]。本研究基于微流控技术构建心血管芯片模型,将HUVEC细胞接种于三通道的微流控芯片中,通过蠕动泵控制培养基流动速度为1 μl/min,有利于营养物质的输送和废物排出,与静态培养相比,细胞所处的动态环境更接近体内生理条件,心血管芯片模型中的细胞生长状态良好,形态呈铺路石样。
糖萼是存在于内皮细胞表面的多糖-蛋白复合物,参与调节炎症反应、血管通透性、凝血平衡在内的多种生理过程,是血管内皮细胞发挥生物功能的重要结构[10]。本研究采用免疫荧光染色法,通过FITC-WGA与HUVEC细胞中糖萼的葡萄糖胺基团选择性结合,测量其荧光强度以反映细胞糖萼损伤情况。结果显示,在实验浓度范围内,OA对细胞具有较大毒性,对糖萼组织损害严重;40 μmol/L的GYM对细胞活力有较强的抑制作用,糖萼损伤率高达40.41%;而TTX和CTX两种毒素对HUVEC细胞无明显活力抑制,但是其糖萼组织受损严重,可见这两种毒素虽然本身对细胞不存在明显的毒性作用,但是通过其他途径与细胞上的结构组织相互作用,从而影响细胞的功能表达。
雷公藤甲素是卫矛科植物雷公藤的主要活性成分,具有抗炎、抗菌、抗肿瘤等药理作用,但是对心血管的作用尚未完全明确。张诗雨等[11]发现雷公藤甲素可作用于血管内皮细胞核转录因子NF-κB,改善脂多糖(LPS)刺激HUVEC细胞所产生的炎症反应。宗佳琪等[12]在LPS诱导的内毒血症大鼠的心血管功能损伤研究中,同样也发现雷公藤甲素对血管内皮相似的保护作用。本研究初步探索了雷公藤甲素对毒素致伤的保护作用,结果显示,经1 μmol/L雷公藤甲素预保护后,四种毒素作用下的细胞活力与对照组相当,对实验浓度范围内CTX、TTX、GYM以及低浓度OA所产生的糖萼损伤具有一定保护作用。
综上,本文构建了一种心血管芯片模拟心血管结构与功能,包括血管表面的糖萼组织。应用该芯片考察了OA、TTX、CTX和GYM四种深海毒素的毒性效应,发现四种毒素对HUVEC细胞活力以及表面的糖萼组织具有损伤,且呈一定的剂量关系,而雷公藤甲素对上述毒素致伤具有保护作用。
Evaluation of toxin-induced injury and protective effect of triptolide based on a cardiovascular chip model
doi: 10.12206/j.issn.2097-2024.202206018
- Received Date: 2022-06-06
- Rev Recd Date: 2022-09-01
- Available Online: 2023-07-14
- Publish Date: 2023-03-25
-
Key words:
- cardiovascular chip /
- marine biotoxins /
- glycocalyx damage /
- triptolide
Abstract:
| Citation: | HE Xiaoli, SHI Yiwei, CHEN Lan, LIU Yue, HONG Zhanying. Evaluation of toxin-induced injury and protective effect of triptolide based on a cardiovascular chip model[J]. Journal of Pharmaceutical Practice and Service, 2023, 41(3): 149-154, 159. doi: 10.12206/j.issn.2097-2024.202206018 |




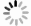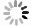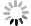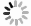

 DownLoad:
DownLoad: